Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

В видео-уроке мы подробно разобрали основные разновидности типов связи:
| Тип связи | Чем образуется* | Пример |
|---|---|---|
| Ковалентная неполярная | Одинаковые Неме | O2, Cl2, C |
| Ковалентная полярная | Разные Неме | CO, SO2, HCl |
| Ионная связь | Ме + Неме | NaCl, BaO, NH4Cl** |
| Металлическая | Ме и сплавы | Fe, Au, латунь |
*Ме – металл, Неме – неметалл.
**исключение. Катион аммония (NH4+) образует ионную связь с анионами кислотного остатка.
А также особый тип связи – водородную, которая может возникать между молекулами, содержащими водород, связанный с высокоэлектроотрицательным элементом (N, O, F).
В ЕГЭ по химии можно встретить задания, в которых нужно найти не просто ковалентную связь, а механизм ее образования.
Обменный.
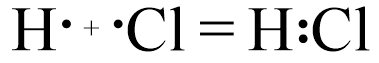
Донорно-акцепторный.
Рассмотрим на примере иона NH4+. Атом азота содержит на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
N 2s22p3
Атом водорода на 1s – подуровне содержит один неспаренный электрон
H 1s1
2р-электроны атома азота образуют три электронные пары с электронами трех атомов водорода по обменному механизму.
На данный момент получилась молекула аммиака – NH3.
У атома азота осталась неподелённая пара электронов на 2s-орбитали.
А ион водорода не содержит электронов на атомной орбитали.
При сближении молекулы аммиака и иона водорода неподеленная пара электронов азота и пустая орбиталь иона водорода взаимодействуют. Они образуют ковалентную полярную связь по донорно-акцепторному механизму. Атом азота является донором электронной пары, а ион водорода – акцептором.
Ковалентная полярная связь по донорно-акцепторному механизму реализуется в таких частицах, как NH4+, BF4-, CO.

Содержание