Задачи на концентрацию
Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

Задачи на концентрацию
По обратимости химические реакции классифицируются на необратимые (обычно в результате этих реакций выделяется осадок, газ или вода) и обратимые.
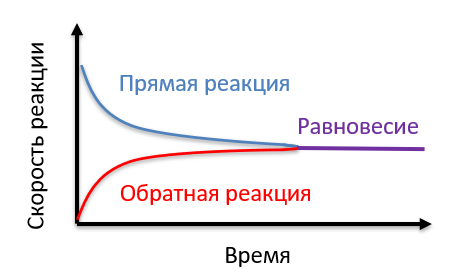
Обратимые реакции называются так, потому что могут протекать как в прямом, так и в обратном направлениях. И прямая, и обратная реакции характеризуются таким понятием, как скорость химической реакции.
В любой период времени концентрации как продуктов, так и реагентов могут быть различными. Однако, в какой-то момент скорости реакций становятся одинаковыми, тогда концентрации веществ в реакционной системе не меняются, такое состояние называется химическим равновесием (равновесным состоянием).
Существует огромное количество факторов, влияющих на равновесие в системе, например, температура, концентрации веществ, давление и т.д. О них мы подробнее поговорим в 11 классе. Сейчас сфокусируемся на концентрации веществ в состоянии химического равновесия.
В данной теме помимо уже известной массовой концентрации вещества (выражается в %), также используется молярная концентрация вещества, которая вычисляется как количество моль данного вещества в 1 литре системы (выражается в моль/л = М).
Рассмотрим прототип задания ЕГЭ, которому соответствует номер 23.
Пример 1:
В реактор постоянного объёма поместили некоторое количество оксида азота (II) и кислорода. В результате протекания обратимой реакции:
2NO(г) + O2(г) = 2NO2(г)
в реакционной системе установилось химическое равновесие. Известно, что исходная концентрация кислорода 0,5 моль/л, оксида азота (II) – 0,8 моль на литр, конечная же концентрация оксида азота (II) составила 0,3 моль на литр. Определите конечные концентрации кислорода (Х) и оксида азота (IV) (Y).
Решение:
Для решения таких задач удобнее использовать таблицу, давайте составим её. Колонки назовем аналогично веществам в системе, а строки озаглавим так:
-
было – то, что изначально смешали;
-
прореагировало – часть вещества, которая израсходовалась или образовалась в результате реакции;
-
стало – концентрации веществ в состоянии равновесия.
| NO | O2 | NO2 | |
|---|---|---|---|
| Было | |||
| Прореагировало | |||
| Стало |
Теперь заполним эту таблицу, исходя из условий задания:
| NO | O2 | NO2 | |
|---|---|---|---|
| Было | 0,8 | 0,5 | - |
| Прореагировало | |||
| Стало | 0,3 | Х | Y |
Определим количество прореагировавшего оксида азота (II). Для этого из того, что было, вычтем то, что стало: 0,8 – 0,3 = 0,5 моль/л. То есть в реакцию вступило 0,5 моль оксида азота (II).
Тогда по уравнению кислорода прореагировало в 2 раза меньше, то есть 0,25 моль, а оксида азота (IV) образовалось ровно столько же, сколько и прореагировало оксида азота (II), то есть 0,5 моль.
| NO | O2 | NO2 | |
|---|---|---|---|
| Было | 0,8 | 0,5 | - |
| Прореагировало | 0,5 (0,8 – 0,3) | 0,25 (0,5/2) | 0,5 |
| Стало | 0,3 | Х | Y |
Теперь найдем значения Х и Y:
Кислорода изначально было 0,5, мы знаем, что прореагировало 0,25, тогда осталось 0,5 – 0,25 = 0,25 моль/л;
Оксида азота (IV) изначально в системе не было, а в результате реакции образовалось 0,5 моль, тогда его конечная концентрация 0 + 0,5 = 0,5 моль/л.
Пример 2:
В реактор постоянного объёма поместили некоторое количество оксида азота (II) и хлора. В результате протекания обратимой реакции
2NO(г) + Cl2(г) = 2NOCl(г)
в реакционной системе установилось химическое равновесие. Известно, что начальная концентрация оксида азота (II) была в 3 раза больше, чем начальная концентрация хлора. Конечная концентрация хлора и NOCl составила 0,1 и 0,6 моль/л соответственно, определите начальную (X) и конечную (Y) концентрацию NO.
Решение:
Составляем таблицу:
| NO | Cl2 | NOCl | |
|---|---|---|---|
| Было | X | - | |
| Прореагировало | |||
| Стало | Y | 0,1 | 0,6 |
Если NOCl изначально не было, тогда в реакции его образовалось 0,6 моль/л, тогда по уравнению реакции можем найти количество ступивших в реакцию NO и Cl2.
| NO | Cl2 | NOCl | |
|---|---|---|---|
| Было | X | - | |
| Прореагировало | 0,6 | 0,3 | 0,6 |
| Стало | Y | 0,1 | 0,6 |
Тогда исходная концентрация хлора: 0,3 + 0,1 = 0,4 моль/л.
По условию задания известно, что исходная концентрация NО в 3 раза больше исходной концентрации Cl2 и, соответственно, составляет 0,4*3 = 1,2 моль/л.
Известно, что в реакцию вступило 0,6 моль/л NO, тогда его конечная концентрация 1,2 – 0,6 = 0,6 моль/л.
| NO | Cl2 | NOCl | |
|---|---|---|---|
| Было | 1,2 | 0,4 | - |
| Прореагировало | 0,6 | 0,3 | 0,6 |
| Стало | 0,6 | 0,1 | 0,6 |

Содержание