Основные понятия в органической химии
Основные понятия в органической химии (гомология и изомерия, гибридизация)
Основные положения теории строения органических веществ А.М. Бутлерова:
-
Атомы в молекуле соединяются в определенной последовательности в соответствии с их валентностями. Углерод в органических веществах всегда четырехвалентен. Атомы углерода могут соединяться друг с другом, образуя цепи.
-
Свойства веществ определяются не только их количественным составом, но и порядком связи атомов друг с другом.
-
По строению молекулы можно предсказать свойства вещества.
Различают два основных вида изомерии: структурную и пространственную.
Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
-
Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
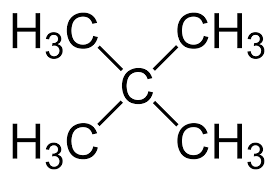
-
Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
-
Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Виды пространственной изомерии:
-
Геометрическая (цис—транс)
-
Оптическая изомерия
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода, то есть атом углерода, связанный с четырьмя различными заместителями.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в sp2, либо в sp-гибридизации:
| Кол-во атомов, с которыми связан атом углерода | Тип гибридизации | Пример |
|---|---|---|
| 4 | sp3 | CH4 |
| 3 | sp2 | CH2=CH2 |
| 2 | sp | CH≡CH или центральный атом в: СН2=С=СН2 |

Содержание

