Химические свойства активных и средней активности металлов
Насколько ты готов к ОГЭ?
Проверь себя и разбери результаты с экспертом
пройти тест

Химические свойства активных и средней активности металлов
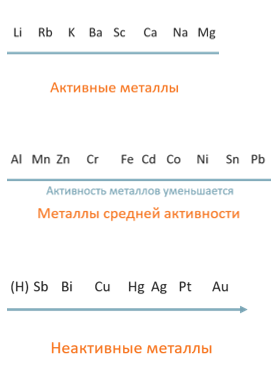
По активности металлы можно разделить на три группы: активные, средней активности и неактивные. Для определения активности металлов используют ряд активности или ряд напряженности металлов (РНМ). Активными считаются металлы, расположенные в ряду до алюминия (иногда алюминий также относят к активным металлам); металлы средней активности – все металлы от алюминия и до водорода; неактивные металлы стоят в РНМ после водорода.
Активные металлы и металлы средней активности можно также разделить на несколько групп: щелочные, щелочноземельные, амфотерные и переходные.
При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Физические свойства:
-
Низкие температуры плавления
-
Мягкие, режутся ножом
-
Хранят под слоем керосина
| Металл | Цвет пламени |
|---|---|
| Li | Карминово-красный |
| Na | Желтый |
| K | Фиолетовый |
Физические свойства:
-
Серые
-
Твёрдые при комнатной температуре вещества
-
Ножом преимущественно не режутся (исключение — стронций)
| Металл | Цвет пламени |
|---|---|
| Ca | Кирпично-красный |
| Sr | Карминово-красный |
| Ba | Желто-зеленый |
Например, алюминий, бериллий.
-
Бериллий – элемент IIA группы, второго периода. Относительно твёрдый, но хрупкий металл серебристо-белого цвета.
-
Алюминий – элемент IA группы, третьего периода. Простое вещество— лёгкий металл серебристо-белого цвета, легко поддающийся литью, механической обработке.
-
Амфотерными свойствами также обладает цинк. В чистом виде — довольно пластичный серебристо-белый металл. При комнатной температуре хрупок, при сгибании пластинки слышен треск.
Например, железо, хром.
Химические свойства металлов:
-
С неметаллами:
2K + S = K2S
4Cr + 3O2 = 2Cr2O3
-
С водой:
Ca + 2H2O = Ca(OH)2 + H2
3Fe + 4H2O =t Fe3O4 + 4H2
-
С растворами кислот:
Sr + 2HBr = SrBr2 + H2
-
Реакция с концентрированной серной кислотой:
-
Металлы до Al: 8Li + 5H2SO4 к = 4Li2SO4 + H2S + 4H2O
-
Металлы после Al: 2Cr + 6H2SO4 к =t Cr2(SO4)3 + 3SO2 + 6H2O
-
Реакция с азотной кислотой различной концентрации:
-
Активные металлы:
8Na + 10HNO3 к = 8NaNO3 + N2O + 5H2O
10Na + 12HNO3 p = 10NaNO3 + N2 + 6H2O
8Na + 10HNO3 оч. разб. = 8NaNO3 + NH4NO3 + 3H2O
-
Металлы средней активности:
3Mg + 8HNO3 к = 3Mg(NO3)2 + 4H2O + 2NO
4Mg + 10HNO3 p = 4Mg(NO3)2 + 5H2O + N2O
Fe, Cr, Al реагируют с концентрированными кислотами только при нагревании.
-
Металлы средней активности вступают в реакции замещения с растворами солей:
Cr + CuCl2 = CrCl2 + Cu
-
Амфотерные металлы реагируют со щелочами при нагревании и в растворе.
2Al + 2NaOH + 6Н2О = 2Na[Al(OH)4] + 3H2↑
2Al + 2NaOH + 2Н2О =t 2NaAlO2 + 3H2↑

Содержание