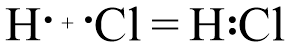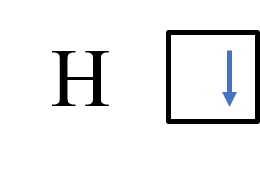Ковалентная полярная химическая связь
Насколько ты знаешь эту тему?
Проверь себя и разбери результаты с экспертом
пройти тест

Ковалентная полярная химическая связь
Различают три случая образования химической связи:
1. Между атомами элементов, электротрицательность которых одинакова.
2. Между атомами элементов, электроотрицательность которых различается незначительно.
3. Между атомами элементов, электроотрицательность которых различается сильно.
Если говорить о ковалентной полярной связи, то нас интересует второй случай. Между атомами, соединенными ковалентной полярной связью, различия в электротрицательности незначительны.
Если атомы, которые соединены ковалентной связью, незначительно различаются по электроотрицательности, происходит смещение общей электронной пары в сторону более электроотрицательного элемента.
В части молекулы, где находится более электроотрицательный элемент, накапливается избыток отрицательного заряда, а где находится менее электроотрицательный элемент – избыток положительного заряда.
Молекула становится диполем – электрически нейтральной частицей, концы которой противоположно заряжены.
Механизмы образования ковалентной связи:
-
Обменный.
-
Заключается в том, что каждый из соединяющихся атомов дает по одному неспаренному электрону на образование общей электронной пары (связи)
-
-
Донорно-акцепторный.
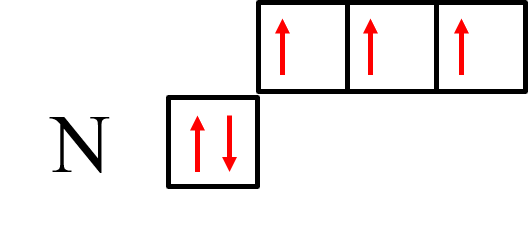
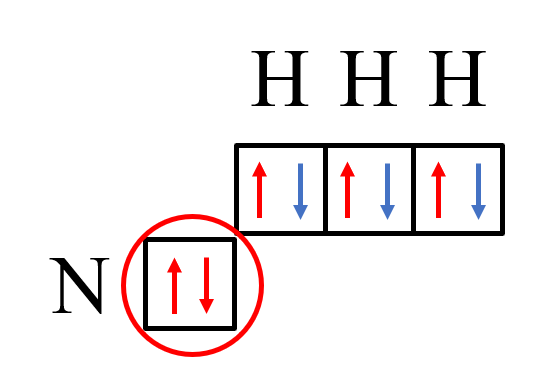
Рассмотрим на примере иона NH4+. Атом азота содержит на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
N 2s22p3
Атом водорода на 1s – подуровне содержит один неспаренный электрон
H 1s1
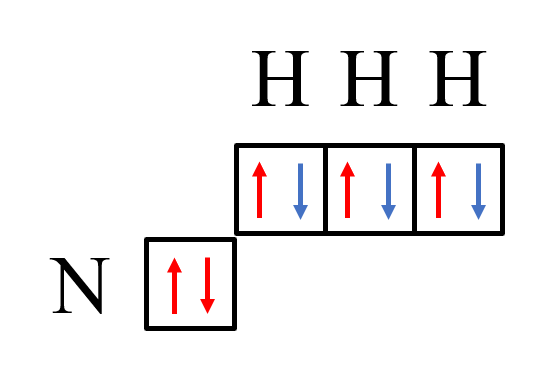
2р-электроны атома азота образуют три электронные пары с электронами трех атомов водорода по обменному механизму.
На данный момент получилась молекула аммиака – NH3.
У атома азота осталась неподелённая пара электронов на 2s-орбитали.
А ион водорода не содержит электронов на атомной орбитали.
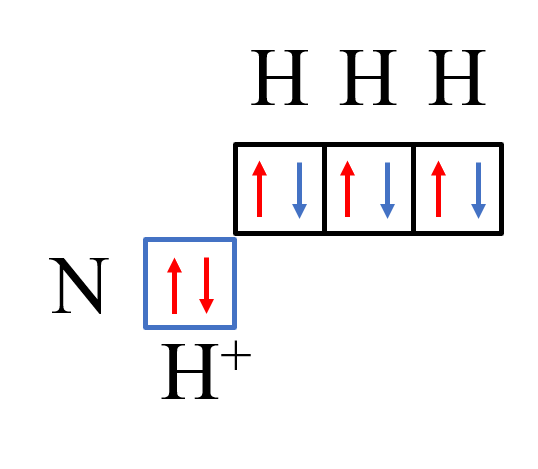
При сближении молекулы аммиака и иона водорода неподеленная пара электронов азота и пустая орбиталь иона водорода взаимодействуют. Они образуют ковалентную полярную связь по донорно-акцепторному механизму. Атом азота является донором электронной пары, а ион водорода – акцептором.
Ковалентная полярная связь по донорно-акцепторному механизму реализуется в таких частицах, как NH4+, BF4-, CO.

Содержание