Химические свойства оксидов
Насколько ты знаешь эту тему?
Проверь себя и разбери результаты с экспертом
пройти тест

Химические свойства оксидов
Оксиды делятся на несколько групп – кислотные, основные, амфотерные и несолеобразующие. Кислотные оксиды соответствуют кислотам, основные – основаниям, амфотерные – амфотерным гидроксидам. Несолеобразующие оксиды не соответствуют ни кислотам, ни основаниям.
Степень окисления элемента (металла или неметалла) в оксиде обуславливает его принадлежность к определенной группе. Так, если элемент в оксиде представлен в виде металла, то степень окисления (СО) будет определять его класс следующим образом:
| СО металла +1, +2 | СО металла +3, +4 | СО металла +5, +6, +7 |
|---|---|---|
| Основный | Амфотерный | Кислотный |
| Пример: Na2O, BaO | Пример: Al2O3, MnO2 | Пример: CrO3, Mn2O7 |
| Иск. BeО, ZnO, SnO, PbO - амфотерные | Иск. BeО, ZnO, SnO, PbO – амфотерные при СО +2 | – |
Если оксид образован элементом - неметаллом, то распределение по классам оксидов будет выглядеть так:
| СО неметалла +1, +2 | СО неметалла больше или равна +3 |
|---|---|
| Несолеобразующий | Кислотный |
| Пример: N2O, NO | Пример: N2O5, CO2 |
| Иск. Cl2O - кислотный | Иск. Cl2O – кислотный при СО +1 |
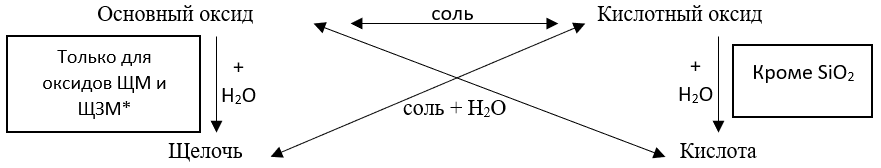
Общими свойствами кислотных и основных оксидов являются кислотно – основные взаимодействия, которые можно отразить в виде схемы.
*ЩМ – щелочные металлы и ЩЗМ – щелочноземельные металлы.
То есть основные оксиды реагируют с кислотными оксидами, с кислотами, с водой (если образованы ЩМ или ЩЗМ), но не реагируют с другими основными оксидами и щелочами.
-
CaO + CO2 → CaCO3
-
CaO + 2HNO3 → Ca(NO3)2 + H2O
-
СаО + Н2О → Ca(ОН)2
Кислотные оксиды реагируют с основными оксидами, щелочами и водой (кроме оксида кремния (IV)). Не реагируют с кислотами и кислотными оксидами.
-
SO2 + K2O → K2SO3
-
CO2 + 2NaOH(избыток) → Na2СO3 + H2O
-
SO3 + Н2О → H2SO4
-
CrO3 + Н2О → H2CrO4
Амфотерные оксиды обладают и кислотными, и основными свойствами. Подробнее рассмотрим их в курсе 9 класса.

Содержание