Простые вещества - металлы
Насколько ты знаешь эту тему?
Проверь себя и разбери результаты с экспертом
пройти тест

Простые вещества – металлы
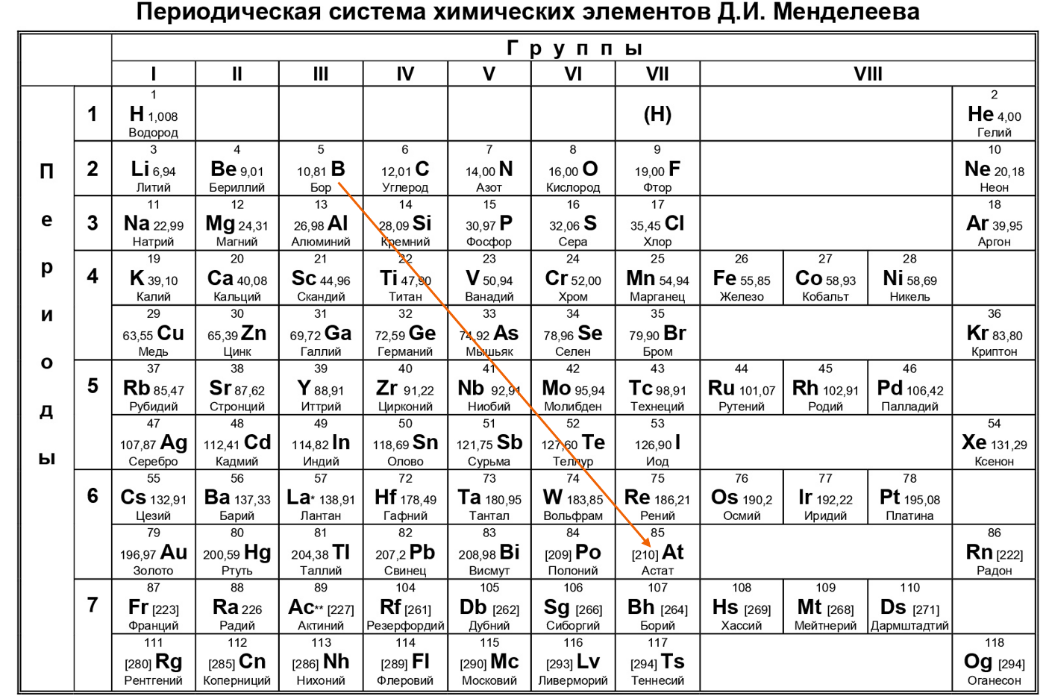
Чтобы определить положение металлов в таблице Менделеева, необходимо провести диагональ от бора к астату. Все элементы, которые располагаются слева от нее, а также которые находятся в побочных подгруппах, являются металлами.
Металлы можно разделить на несколько групп: щелочные, щелочноземельные, амфотерные и переходные.
Щелочные металлы обладают низкими температурами кипения, они мягкие (как воск) и их можно разрезать ножом. Они очень активные и бурно реагируют с водой с образованием щелочей, поэтому эти металлы хранят под слоем керосина.
Внешне эти металлы серые и твердые при комнатной температуре. Их нельзя разрезать ножом, за исключением стронция. Эти металлы также являются достаточно активными.
Бериллий – это относительно твердый, но хрупкий металл серебристо-белого цвета. Алюминий является легким металлом также серебристо-белого цвета, из него изготавливают различные предметы посуды, так как он легко поддается литью и механической обработке. Амфотерными свойствами также обладает цинк. В чистом виде — довольно пластичный серебристо-белый металл. При комнатной температуре хрупок, при сгибании пластинки слышен треск.
Химические свойства металлов зависят от их активности. Активность металлов можно определить с помощью ряда активности, или, как его еще называют, ряда напряженности металлов. Условно металлы можно разделить на три группы: активные (находятся в ряду до алюминия), средней активности (от алюминия и до водорода) и неактивные (после водорода).
Рассмотрим химические свойства активных металлов и металлов средней активности.
-
С неметаллами:
2K + S = K2S
4Cr + 3O2 = 2Cr2O3
-
С водой:
Ca + 2H2O = Ca(OH)2 + H2
3Fe + 4H2O =t Fe3O4 + 4H2
-
С растворами кислот:
Sr + 2HBr = SrBr2 + H2
-
Металлы средней активности вступают в реакцию замещения с растворами солей:
Cr + CuCl2 = CrCl2 + Cu
-
Амфотерные металлы реагируют со щелочами при нагревании и в растворе.
2Al + 2NaOH + 6Н2О = 2Na[Al(OH)4] + 3H2↑
2Al + 2NaOH + 2Н2О =t 2NaAlO2 + 3H2↑
Неактивные металлы стоят в ряду активности после водорода, поэтому они не реагируют с кислотами и с водой. Запишем реакции с участием неактивных металлов:
-
Образование оксидов:
2Cu + O2 = 2CuO
-
С другими неметаллами:
Cu + S = CuS
-
Не взаимодействуют с водой и растворами кислот.
-
Вступают в реакцию замещения с растворами солей:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag

Содержание