Квантовая механика
Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

Квантовая механика
Оказалось, что свет проявляет двойственную природу. В некоторых явлениях он ведёт себя как электромагнитная волна (дифракция, интерференция, дисперсия), а в некоторых ― как поток частиц, которые получили название фотонов.
Длина волны фотона: \(\lambda = \frac{c}{v}\)
c ― скорость света [м/с]
λ ― длина волны света [м]
v ― частота света [Гц] или [1/c].
Энергия фотона прямо пропорциональна частоте света и равна \(Е = hv\) , где
Е ― энергия фотона [Дж];
\(v\) ― частота света [Дж];
h ― постоянная Планка равная \(6,6 \bullet 10^{- 34}\) [Дж/с].
\(p = \frac{h}{\lambda}\)
p ― импульс фотона [кг∙м/с];
λ ― длина волны фотона [м];
h ― постоянная Планка равная \(6,6 \bullet 10^{- 34}\) [Дж/с].
Постулаты Бора:
-
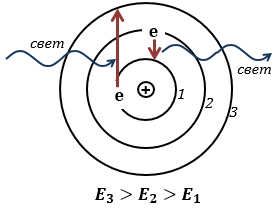
Электрон, вращаясь вокруг ядра, может находиться только на стационарных орбитах. Вращаясь на стационарной орбите, электрон не испускает свет, и не теряют энергию.
-
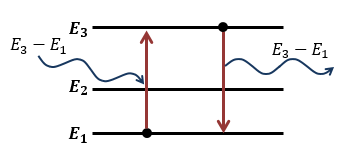
Электрон испускает свет, только переходя с уровня с большей энергией на уровень с меньшей энергией. Поглощая свет, электрон переходит с уровня с меньшей энергией на уровень с большей энергией.
\(E_{\nu}\) ― энергия фотона, [Дж] или [эВ];
\(E_{k}\) ― энергия электрона до того, как он поглотил или излучил фотон, [Дж] или [эВ]
\(E_{m}\) ― энергия электрона после того, как он поглотил или излучил фотон, [Дж] или [эВ]
Энергия атомов и фотонов выражается в джоулях [Дж] или электронвольтах: \(1\ \lbrack эВ\rbrack\ = \ 1,6 \cdot 10^{- 19}\) [Дж].
Переход электронов с уровня на уровень в планетарной модели атома
Так как подобное изображение уровней громоздко, в задачах принято показать энергетические уровни, расположенные линейно друг над другом:
Поскольку энергия фотона прямо пропорциональна его частоте, по частоте поглощенного или излученного кванта света, можно определить с какого на какой уровень переходил электрон:
\(v_{k - m}\) ― частота фотона, который поглощается (или излучается) при переходе с уровня k на уровень m, [Гц]
h ― постоянная Планка равная \(6,6 \bullet 10^{- 34}\) [Дж∙с]
\(E_{k}\) ― энергия электрона до того, как он поглотил или излучил фотон, [Дж]
\(E_{m}\) ― энергия электрона после того, как он поглотил или излучил фотон, [Дж]
Химические элементы отличаются количеством протонов в ядре ― а, следовательно, и электронов, вращающихся вокруг ядра. Поэтому у каждого химического элемента уникальный набор энергетических уровней, на которых могут находиться электроны. Переходя с одного уровня на другой, электроны излучают строго определенную порцию энергию ― т. е. квант с определенной длинной волны. Измерив длину волны фотонов, которые испускает разогретый атомарный газ, можно определить природу этого газа.
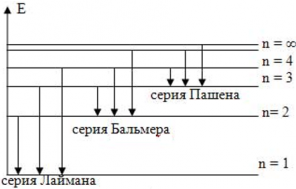
Энергетические уровни атома водорода
\(E_{n}\) ― энергия электрона в атоме водорода, находящегося на уровне n, [эВ]
n ― номер уровня
–13,6 эВ ― энергия ионизации, т. е. энергия, которую необходимо затратить, чтобы отортвать электрон от атома.
При переходе электронов в атоме водорода на уровень n = 3 в спектре излучения наблюдается характерная картина линий излучения ― «серия Пашена», при переходе электронов на уровень n = 2 ― серия Бальмера, при переходе на уровень n = 1 ― серия Лаймана.
Рассмотрим электрон, находящийся на 1 орбитали в атоме водорода. Энергия этого уровня \(Е\ = \ –13,6\ эВ\). Это значит, что если сообщать электрону как минимум 13,6 эВ энергии, он переместится на нулевой уровень — расстояние от ядра, на котором электрон может вырваться от сил, притягивающих его обратно. Следовательно, получив такую энергию, электрон покидает ядро, иными словами — ионизируется.
Минимальная энергия, которая требуется на ионизацию, всегда равна энергии уровня, на котором находится электрон (для первого уровня в атоме водорода: 13,6 эВ; для второго: 3,4 эВ и так далее).
Если электрон поглотит фотон с энергией большей, чем требуется на ионизацию, то часть энергии будет потрачена на ионизацию, а остатки — на кинетическую энергию электрона вдали от ядра:
\(v_{ион}\) ― частота фотона, который поглощается электроном и вызывает ионизацию, [Гц]
h ― постоянная Планка равная \(6,6 \bullet 10^{- 34}\) [Дж∙с]
\(E_{0}\) ― минимальная энергия, необходимая для ионизации с данного уровня, [Дж]
\(E_{k}\) ― кинетическая энергия электрона вдали от ядра, [Дж]

Наши социальные сети
Подписывайся!
Экономь время
на подготовке в ТГ
Забирай полезные чек-листы, памятки и лайфхаки
Подписаться →

Изучай новое
без усилий в ВК
Смотри полезные видео и вебинары, где объясняем сложное простым языком
Подписаться →

Забирай полезное в Максимум БЛОГЕ
Узнай первым лайфхаки по решению заданий предстоящего экзамена
Подписаться →

Содержание