Фазовые переходы
Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

Фазовые переходы
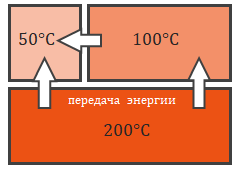
Энергия всегда передается от более нагретого тела к менее нагретому.
Температура тел, находящихся в тепловом равновесии, одинакова.
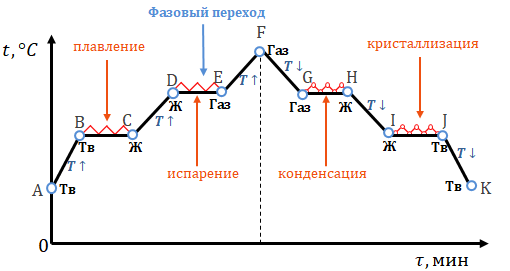
Изменение состояния вещества (плавление, кристаллизация, кипение) происходит при постоянной температуре.
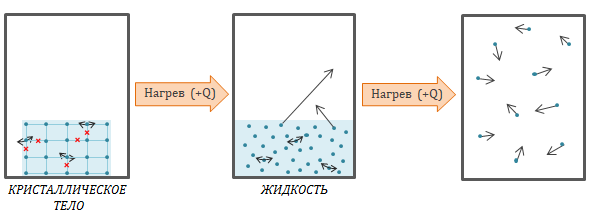
При плавлении энергия поглощается и тратится на разрыв связи между ионами.
При кипении энергия поглощается и тратится на разрыв связи между молекулами (совершается работа выхода).
При конденсации и кристаллизации энергия выделяется, и образовываются связи между молекулами и ионами.
Если веществу сообщают тепло, то внутренняя энергия увеличивается.
Если вещество отдаёт тепло, то внутренняя энергия уменьшается.
\(Q\) — поглощенная или выделенная энергия [Дж]
\(m\) — масса тела [кг]
\(c\) — теплоёмкость тела [\(\frac{Дж}{кг \bullet К}\)]
\(t_{2}\) — конечная температура тела [\(℃\)]
\(t_{1}\) — начальная температура тела [\(℃\)]
Если вещество поглощает энергию, то \(Q > 0.\)
Если вещество отдаёт энергию, то \(Q < 0\).
\(Q\) — энергия [Дж]
\(m\) — масса вещества [кг]
\(\lambda\) — удельная теплота плавления\ парообразования\ конденсации\ кристаллизации [Дж/кг]

Наши социальные сети
Подписывайся!
Экономь время
на подготовке в ТГ
Забирай полезные чек-листы, памятки и лайфхаки
Подписаться →

Изучай новое
без усилий в ВК
Смотри полезные видео и вебинары, где объясняем сложное простым языком
Подписаться →

Забирай полезное в Максимум БЛОГЕ
Узнай первым лайфхаки по решению заданий предстоящего экзамена
Подписаться →

Содержание