Молекулярно-кинетическая теория
Насколько ты готов к ЕГЭ?
Проверь себя и разбери свои результаты с экспертом
пройти тест

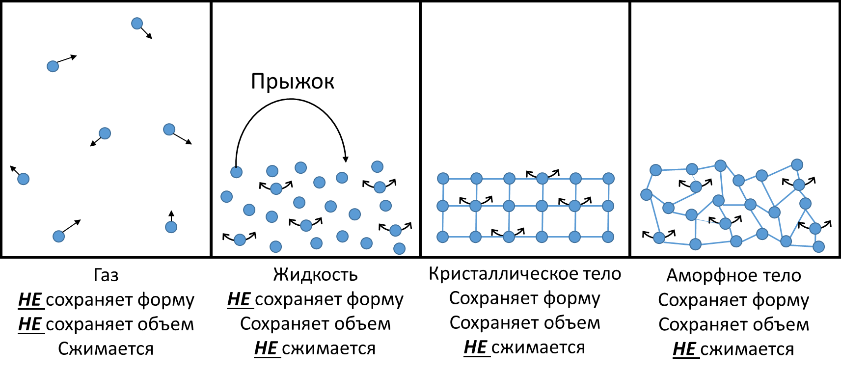
Молекулярно-кинетическая теория
-
Все тела состоят из мельчайших частиц: молекул, атомов или ионов;
-
Эти частицы постоянно и хаотически двигаются;
-
Между частицами существует взаимодействие: на больших расстояниях они притягиваются, а на маленьких ― отталкиваются.
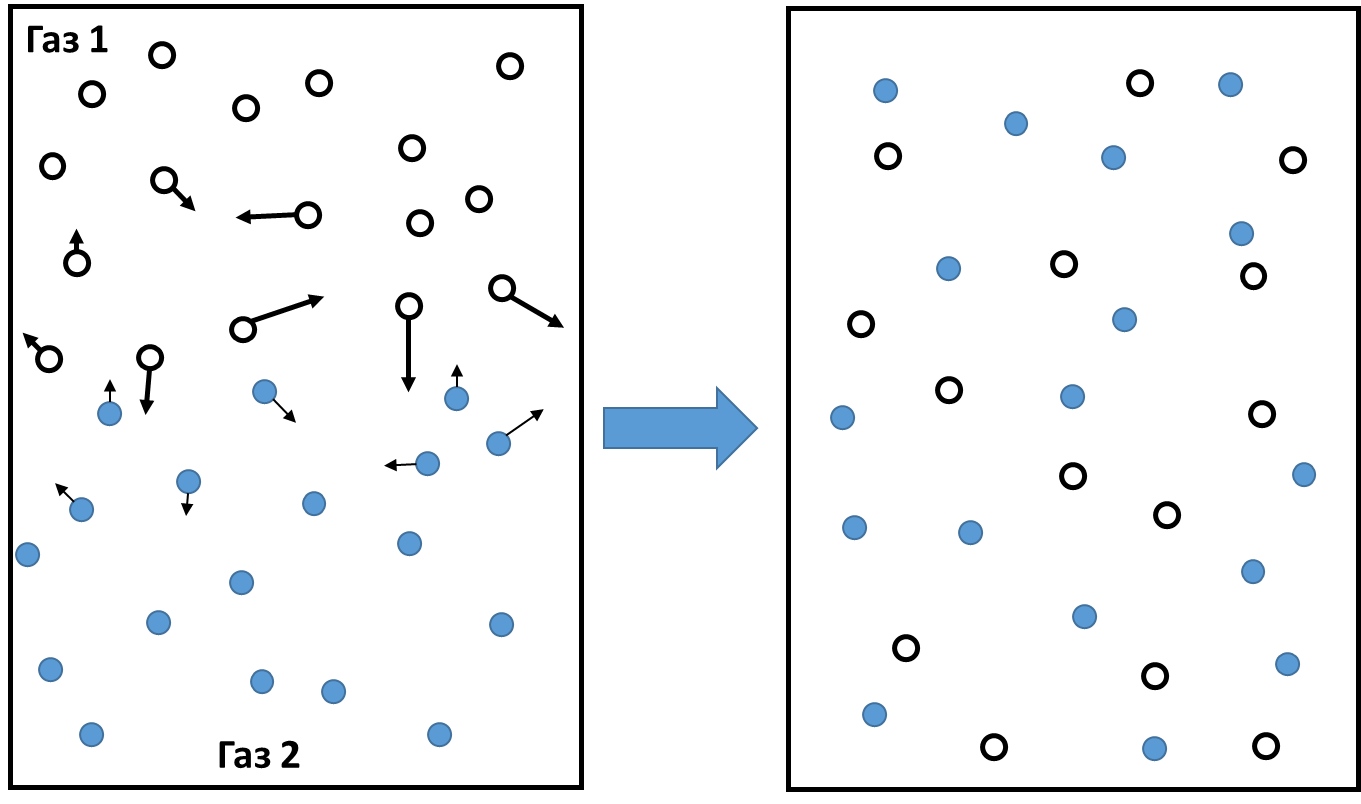
Свойства диффузии:
-
Происходит во всех агрегатных состояниях: газы, жидкости, твердые тела
-
Быстро протекает в газах, медленней в жидкостях и самая медленная в твердых телах
-
Скорость диффузии увеличивается с повышением температуры и наоборот
-
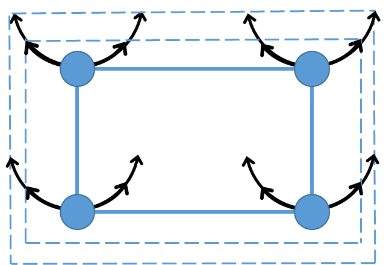
Молекулы двигаются быстрее при повышении температуры
-
Молекулы двигаются медленнее при понижении температуры
T(K) = T(C) + 273°, где T(K) и T(C) ― это температура в соответствующих шкалах температур.
С увеличением температуры объем тела увеличивается.
Способы передачи тепла:
-
Конвекция (осуществляется преимущественно в жидкости);
-
Теплопередача (осуществляется преимущественно в твёрдых телах);
-
Лучистый теплообмен.
-
Внутренняя энергия увеличивается при повышении температуры и уменьшается при понижении;
-
Внутренняя энергия не зависит от движения тела как целого.
Количество вещества газа: \(\nu = \frac{m}{M} = \frac{N}{N_{А}}\)
ν — количество вещества [моль]
m — масса газа [кг]
М — молярная масса газа [кг/моль]
N — количество молекул газа
NА — постоянная Авогадро, равная 6∙1023 [ 1/моль ]
Концентрация газа: \(n = \frac{N}{V}\)
n — концентрация молекул [1/м3]
N — количество молекул газа, распределенных по объему
V — объем газа [м3]
Средняя кинетическая энергия теплового движения молекул газа: \(E_{к} = \frac{3}{2}\text{kT}\)
Eк — средняя кинетическая энергия теплового движения молекул [Дж]
k — постоянная Больцмана, равная 1,38 ∙ 10-23 [Дж/К]
Т — средняя температура молекул газа [К]
Газ оказывает по всем направлениям одинаковое давление.
Основное уравнение МКТ: \(p = nkT = \frac{2}{3}nE_{к} = \frac{1}{3}\text{nm}{< v >}^{2}\)
p — давление газа [Па]
n — концентрация молекул [1/м3]
Т — средняя температура молекул газа [К]
Eк — средняя кинетическая энергия теплового движения молекул [Дж]
m — средняя масса молекул газа [кг]
<v> — среднеквадратичная скорость движения молекул газа [м/с]
k — постоянная Больцмана, равная 1,38∙10-23 [Дж/К]
Если объединить основное уравнение МКТ, формулу концентрации, количества вещества и произвести замену (\(k \bullet \text{Na} = R\)), то получится основное уравнение молекулярной физики:
Уравнение состояния идеального газа (Менделеева – Клапейрона): \(pV = \nu RT\)
p — давление газа [Па]
V — объем газа [м3]
ν — количество вещества [моль]
R — универсальная газовая постоянная, равная 8,31 [Дж/моль∙К]
Т — средняя температура молекул газа [К]

Наши социальные сети
Подписывайся!
Экономь время
на подготовке в ТГ
Забирай полезные чек-листы, памятки и лайфхаки
Подписаться →

Изучай новое
без усилий в ВК
Смотри полезные видео и вебинары, где объясняем сложное простым языком
Подписаться →

Забирай полезное в Максимум БЛОГЕ
Узнай первым лайфхаки по решению заданий предстоящего экзамена
Подписаться →

Содержание