Газовые процессы
Газовые процессы
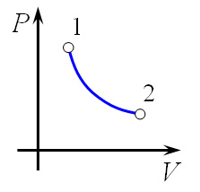
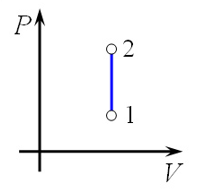
Следовательно, температура Т не меняется, и значение давления обратно пропорционально объёму(гипербола): \(p = \frac{\text{νRT}}{V} = \frac{\text{const}}{V} \rightarrow y = \frac{a}{x}\).
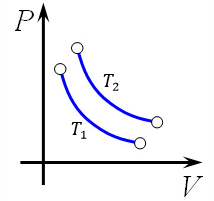
Изотерма с температурой \(T_{2}\) будет располагаться на диаграмме \(\text{pV}\) выше, чем изотерма с температурой \(T_{1}\), как следствие закона \(\text{pV} = \text{vRT}\). Так как при большем значение температуры значение коэффициента перед \(V\) в уравнении \(p = \frac{\text{νRT}}{V}\) будет больше \((\text{vR}T_{2}\ ˃\ \text{vR}T_{1})\), следовательно, гипербола будет выше.
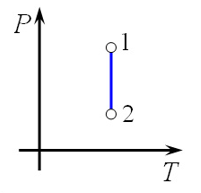
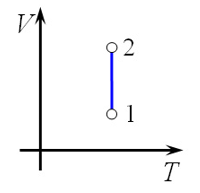
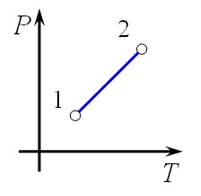
Следовательно, объем V не изменяется, и значение давления прямолинейно зависит от температуры.
Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма, например, в запаянном сосуде.
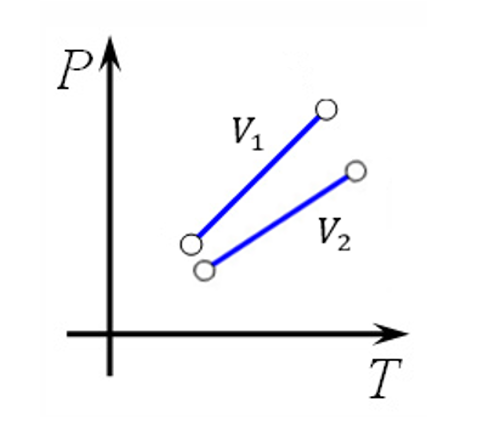
Изохора с \(V_{1}\) будет выше \(V_{2}\), аналогично, как следствие закона \(\text{pV} = \text{vRT}\). Так как при большем значении объема, коэффициент при \(Т\) будет меньше \((\frac{\text{νR}}{V_{2}} < \frac{\text{vR}}{V_{1}})\), а следовательно и прямая на диаграмме \(\text{pT}\), будет ниже.
Простейшим примером изобарического процесса может служить нагревание воды в открытом сосуде.

Содержание