Газовые циклы
Газовые циклы
При изменении объёма газ совершает работу.
\(A\) — работа газа [Дж]
\(p\) — давление газа [Па]
\(\mathrm{\Delta}V\) — изменение объёма [м3]
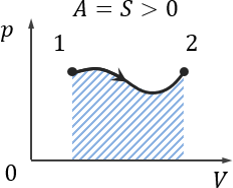
Если газ расширяется, то работа газа положительна, A > 0.
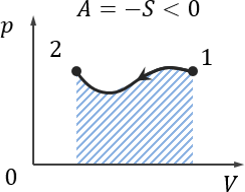
Если газ сжимается, то работа газа отрицательна, A < 0.
Если не происходит изменения объема газа, то работа равна нулю, A = 0.
Работа, совершаемая над газом равна работе, совершаемой газом, но взятой с обратным знаком: \(A_{над\ газом} = - A_{газа}\)
Работа газа — площадь под кривой на pV-диаграмме.
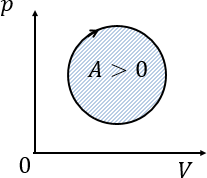
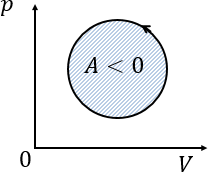
Работа газа за цикл — площадь внутри замкнутой фигуры
Если цикл совершается по часовой стрелке, то работа газа за цикл положительна.
Если цикл совершается против часовой стрелки, то работа газа за цикл отрицательна.
\(U\) — внутренняя энергия [Дж]
\(\nu\) — количество вещества газа [моль]
\(R\) — универсальная газовая постоянная, равная 8,31 [Дж/моль∙К]
\(T\) — температура газа в Кельвинах [К]
Если температура газа увеличивается, то изменение внутренней энергии газа положительно, ΔU > 0.
Если температура газа уменьшается, то изменение внутренней энергии газа отрицательно, ΔU < 0.
Если температура газа не изменяется, то изменение внутренней энергии газа равно нулю, ΔU = 0.
\(Q = \mathrm{\Delta}U + A\)
\(Q\) — тепло, полученное газом [Дж]
\(\mathrm{\Delta}U\) — изменение внутренней энергии [Дж]
\(A\) — работа газа [Дж]
Адиабатическими могут считаться либо очень быстрые процессы, либо процессы в теплоизолированной среде.
В первом начале термодинамики при адиабатическом процессе необходимо положить Q = 0.
\(\eta\) — коэффициент полезного действия, КПД [%]
\(Q_{н}\) — количество теплоты, полученное от нагревателя [Дж]
\(Q_{х}\ \)— количество теплоты, отданное холодильнику [Дж]
\(A_{п}\) — полезная работа газа, равная \(A_{п} = Q_{н} - Q_{х}\) [Дж]
КПД цикла Карно определяется температурами нагревателя и холодильника:
\(\eta = \left( 1 - \frac{Т_{х}}{Т_{н}} \right) \cdot 100\%\)
\(\eta\) — коэффициент полезного действия, КПД [%]
\(Т_{н}\) — температура нагревателя [К]
\(Т_{х}\) — температура холодильника [К]

Содержание